Los médicos aseguran que, esta vez sí, estamos ante una revolucionaria forma de combatir la enfermedad, sobre todo en varios tipos de cáncer. Se trata de las terapias celulares o génicas, tratamientos personalizados donde a cada paciente se le extraen células que son modificadas en laboratorio para incluirles un gen capaz de actuar contra las células malignas. Una vez que las células son modificadas, se inyectan de nuevo en cada paciente.
De momento, han sido dos grandes multinacionales farmacéuticas, la suiza Novartis y la estadounidense Gilead, las que han llevado estos ensayos hasta el final y ya han mostrado los resultados. El fármaco de Novartis ha mostrado tasas de curación superior al 80%, tanto en un tipo de leucemia infantil como en un linfoma de adultos. El de Gilead, parecidas tasas de eficacia en un tipo de linfoma no Hodgkin en adultos.
Estas terapias génicas están basadas en las llamadas células T junto a un receptor de antígeno quimérico (CAR-T) que aprovecha el sistema inmunitario del paciente para combatir determinados tipos de cáncer hematológico. En concreto, la terapia aprobada ya en España de Novartis, denominada Kimryah, está indicada para tratar la leucemia linfoblástica aguda (LLA) de células B refractaria, en recaída post trasplante o en segunda o posterior recaída en pacientes pediátricos y adultos jóvenes de hasta 25 años de edad y para la indicación de Linfoma B difuso de célula grande (LBDCG), en recaída o refractario tras dos o más líneas de tratamiento sistémico en pacientes adultos.
La de Gilead, aún en fase de negociación en nuestro país, se llama Yescarta y está indicada para tratamiento de pacientes adultos con linfoma B difuso de células grandes (Lbdcg) en recaída o refractario y linfoma primario mediastínico de células B grandes (LBPM), después de dos o más líneas de tratamiento sistémico.
"Estamos adentrándonos en una nueva frontera de la innovación médica, con la capacidad de reprogramar las células del paciente para que ataquen un cáncer mortal", asegura el doctor Scott Gottlieb, comisionado de la FDA, la agencia que aprueba los fármacos en EEUU.
300 ensayos en marcha
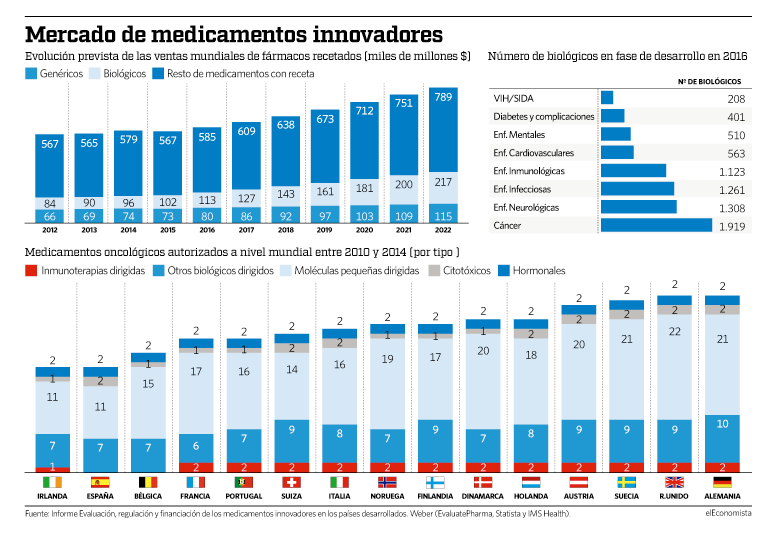
Según los últimos datos de Pharma, la asociación de compañías farmacéuticas innovadoras de Estados Unidos, actualmente hay 289 terapias génicas y celulares en fase de I+D para el tratamiento de un centenar de patologías. Más de un tercio de estas nuevas terapias (111) se dirigen a tratar distintos tipos de cáncer.
Además de las dos inmunoterapias basadas en células CAR-T de Novartis y Gilead, ya hay otra terapia génica aprobada para tratar la amaurosis de Leber (enfermedad congénita de la retina) y está en marcha una vacuna contra el cáncer de próstata basada también en inmunoterapia y un tratamiento de ARN de interferencia contra la amiloidosis cardiaca por transtiretina.
La existencia de este tipo de avances es producto de innumerables investigaciones desde que, hace medio siglo, se descubriera la posibilidad de alterar directamente los genes humanos. Hoy, la irrupción de la llamada medicina de precisión supone el inicio de una nueva era en el abordaje de las enfermedades, que tiene en el desarrollo de las terapias génicas y celulares sus principales exponentes.
Modificar los genes
En ambos casos se trata de modificar el material genético humano para combatir enfermedades, pero mientras que la terapia celular supone la infusión o reintroducción de células completas en el organismo, la terapia génica se basa en la modificación o introducción de genes previamente alterados a través de distintos vectores (principalmente virus). Por supuesto, ambas técnicas se pueden combinar, como ocurre en el caso de las terapias basadas en células CAR-T, donde las células se extraen del cuerpo, se modifican genéticamente fuera del organismo y se reintroducen en el paciente para su tratamiento.
A estos procedimientos cabe sumar otros integrados en el campo de la medicina regenerativa, como la ingeniería de tejidos y el desarrollo de biomateriales, que configuran un escenario completamente nuevo que sienta las bases de la medicina del futuro.
Si bien es cierto que los distintos tipos de cáncer son el objetivo de más de un tercio de estas terapias, otras enfermedades han sido también objeto de los esfuerzos de los investigadores. Se trata de las patologías oculares, ámbito donde hay 28 terapias en desarrollo, las cardiovasculares (24), las neurológicas (22), las de la sangre (21), las genéticas (15) o las infecciosas (13), entre otras.
En cualquier caso, el proceso de I+D de un nuevo medicamento es un camino lleno de obstáculos, de muy larga duración (10-12 años de media), que supone una enorme inversión y que además resulta muy arriesgado, ya que apenas uno de cada diez mil potenciales fármacos en investigación llegará a finalmente al paciente.
De hecho, lograr que estas investigaciones en nuevas terapias génicas y celulares lleguen a ser tratamientos autorizados en todos los países es el gran reto, dada la complejidad de manejo que tienen y las exigencias de evaluación y fabricación. La consecuencia de esta mayor complejidad es que la inversión global que requiere todo el proceso de desarrollo de un fármaco, desde su identificación molecular hasta la aprobación y llegada al paciente, prácticamente se ha duplicado en los últimos 15 años.
Inversión para descubrir nuevas moléculas
La industria farmacéutica innovadora es protagonista directa en el desarrollo de esta nueva manera de combatir la enfermedad. La inversión en innovación de los laboratorios en todo el mundo cada año es de más de 132.000 millones de euros. Cuando un medicamento llega al paciente han transcurrido de media entre 10 y 12 años, consumidos en las distintas fases de investigación y desarrollo. Este trayecto requiere un esfuerzo económico de alrededor de 2.400 millones de euros y genera un gran riesgo de fracaso: sólo una de cada 10.000 moléculas que se empieza a investigar termina convertida en un tratamiento disponible para los pacientes. En la última década, el número de medicamentos de precisión comercializados crece un 50% de media anual, desde los cinco de 2008 a los 132 de 2016. Y hay cerca de 1.100 en investigación en distintas fases de desarrollo clínico. En los próximos años, más de la mitad de los fármacos en desarrollo responderá al concepto de medicina personalizada.