
Que la innovación es un elemento indispensable para cualquier compañía es ya una máxima de la que pocos dudan. ¿Pero y qué hay de aquellas innovaciones que además de hacerte crecer como organización se traducen en beneficios en el bienestar y la salud de las personas? Éstos son, desde luego, los avances que hacen historia y marcan el futuro y la tendencia a seguir dentro de un sector.
Que la innovación es un elemento indispensable para cualquier compañía es ya una máxima de la que pocos dudan. ¿Pero y qué hay de aquellas innovaciones que además de hacerte crecer como organización se traducen en beneficios en el bienestar y la salud de las personas? Éstos son, desde luego, los avances que hacen historia y marcan el futuro y la tendencia a seguir dentro de un sector.
La multinacional enfocada en oncología, PharmaMar, está precisamente de enhorabuena en este sentido. Líder a nivel mundial en el descubrimiento de antitumorales de origen marino y pionera en la comercialización de un fármaco contra el cáncer de origen marino, la compañía farmacéutica acaba de recibir la aprobación de un fármaco para el tratamiento de cáncer de pulmón microcítico recurrente en EEUU: Lurbinectedina (Zepzelca™).
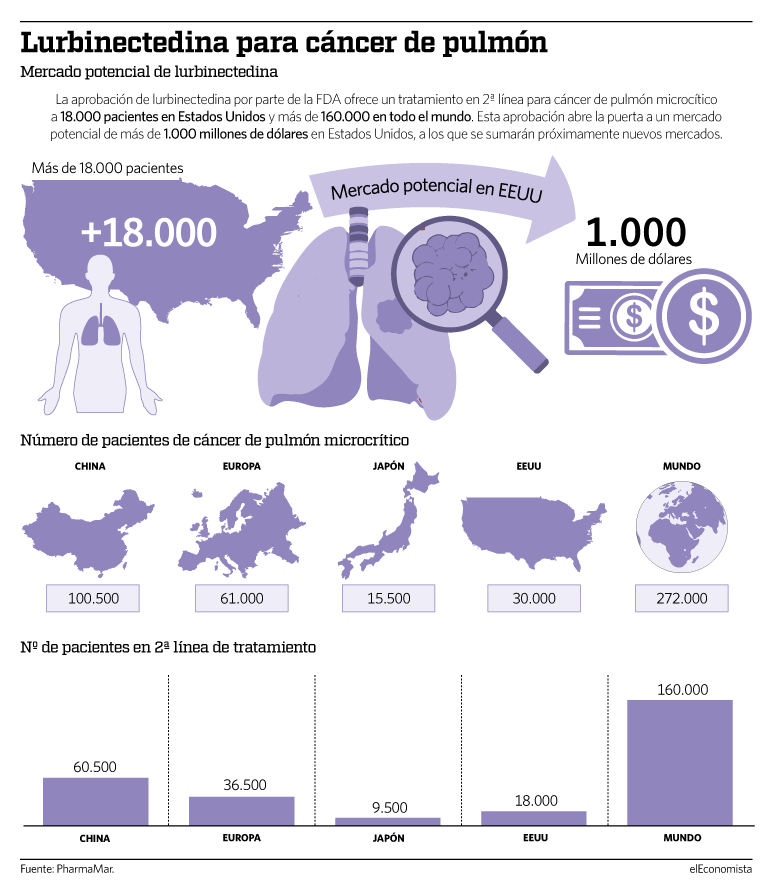
En primer lugar, conviene recordar que hay dos tipos principales de cáncer de pulmón: cáncer de pulmón no microcítico (NSCLC) y el cáncer de pulmón microcítico (SCLC), el que nos compete en este caso. Según la Sociedad Americana contra el Cáncer, entre el 10% y el 15% de todos los cánceres de pulmón son de este tipo (células pequeñas) y a veces se les llama cáncer de células en avena. Se trata de un cáncer que se propaga más rápidamente que el no microcítico; de hecho, en siete de cada diez casos, el cáncer ya se ha extendido en el momento del diagnóstico y, lamentablemente, regresará en algún momento en la mayoría de las personas.
Por eso, este avance de PharmaMar en materia de SCLC marca un antes y un después en su tratamiento. El pasado 15 de junio, la compañía anunció, junto a Jazz Pharmaceuticals, que la FDA (Food and Drug Administration) de EEUU había aprobado lurbinectedina para el tratamiento de pacientes adultos con cáncer de pulmón microcítico metastásico con progresión de la enfermedad, tras un tratamiento con quimioterapia basado en platino.
La aprobación de este fármaco por parte de la FDA se basa en los datos de un estudio en monoterapia, abierto, multicéntrico y de un solo brazo de 105 pacientes adultos sensibles a platino y resistentes a platino, con cáncer de pulmón microcítico recurrente.
Así, los datos mostraron que, en cáncer de pulmón microcítico recurrente, lurbinectedina demostró una ORR (tasa de respuesta objetiva) del 35% -quiere decir proporción de pacientes con reducción en la carga tumoral de una cantidad predefinida- y una mediana de DoR de 5,3 meses según la evaluación del investigador -esto quiere decir duración de la respuesta, es decir, el tiempo que un tumor continúa respondiendo al tratamiento sin que el cáncer crezca o se propague-.
Esta aprobación da la opción de tratamiento en segunda línea a más de 18.000 pacientes de cáncer de pulmón microcítico en Estados Unidos, lo que supone un mercado potencial de 1.000 millones de euros. A nivel mundial, la cifra de pacientes con cáncer de pulmón microcítico es de más de 270.000.
Los próximos pasos en este ámbito consisten en solicitar procesos de aprobación similares al de la FDA a otras entidades regulatorias del resto del mundo, como es el caso de la Administración de Productos Terapéuticos australiana (TGA, Therapeutic Goods Administration). De hecho, este organismo ha concedido recientemente a lurbinectedina la designación de Provisional Approval Pathway, basada en el estudio basket de fase II de lurbinectedina como agente único, que evalúa su eficacia y seguridad en pacientes de cáncer de pulmón microcítico que han sufrido una recaída después de ser tratados con la terapia estándar basada en el platino, con o sin inmunoterapia. Esta designación permite una revisión para su aprobación de forma más rápida.
Además de esta entidad, PharmaMar también está trabajando para lograr otros acuerdos con lurbinectedina en Europa e Israel. En relación con este tema, el pasado mes de abril, la compañía logró alcanzar un acuerdo con el grupo farmacéutico Immedica para la distribución y comercialización en exclusiva, en caso de aprobación, del antitumoral lurbinectedina para un territorio que incluye el Reino Unido, Irlanda, los países nórdicos, algunos países de Europa del Este, de Oriente Medio y Norte de África.
Cuenta con tres productos antitumorales: lurbinectedina para cáncer de pulmón, trabectedina para sarcoma de tejidos blandos y plitidepsina para mieloma múltiple
Por su parte, en mayo, PharmaMar hizo lo propio con la empresa privada de marketing farmacéutico líder en Israel, Megapharm, para comercializar el antitumoral de origen marino lurbinectedina en Israel.
Fármacos innovadores
No obstante, la labor de PharmaMar en el ámbito de la investigación oncológica va mucho más allá de lurbinectedina. Actualmente, la compañía cuenta con tres productos antitumorales en el mercado: lurbinectedina para cáncer de pulmón, trabectedina (Yondelis®) para sarcoma de tejidos blandos y cáncer de ovario, y plitidepsina(Aplidin®) para mieloma múltiple.
Concretamente, en el caso de trabectedina, se emplea para tratar un tipo de cáncer -en palabras de Heiner Pieper, vicepresidente de Desarrollo de Negocio y Licencias de PharmaMar- "relativamente raro, en el que las opciones de tratamiento son limitadas para los pacientes con un estadio avanzado".

Comercializado con el nombre de Yondelis®, este fármaco ejerce sus efectos anticancerígenos principalmente mediante la inhibición de la transcripción activa, un tipo de expresión génica del que dependen especialmente las células cancerígenas que proliferan. Aunque ya se emplea en muchos pacientes de todo el mundo, lo cierto es que PharmaMar continúa firmando acuerdos internacionales para la comercialización de trabectedina, como es el caso de los últimos firmados en Asia y África.
Así, este mismo mes de junio, la empresa ha alcanzado con la compañía farmacéutica biotecnológica TTY Biopharm un acuerdo de licencia exclusiva para la importación, uso, comercialización, venta y distribución de trabectedina en Taiwán, Hong Kong y Macao. Con esta acción, PharmaMar espera que los pacientes tengan un acceso más amplio al tratamiento, una vez que las autoridades sanitarias concedan el reembolso completo de trabectedina.
Para hacer frente al COVID-19, trabaja en plitidepsina, un fármaco que mata al virus con una potencia nanomolar
Mientras que, en el caso de África, la compañía firmó en mayo un acuerdo de esta misma índole con la empresa farmacéutica sudafricana Key Oncologics y que abarca los países de Sudáfrica, Namibia y Botsuana.
Tratamiento del COVID-19
Ante la crisis sanitaria provocada por el COVID-19, han sido muchas las compañías que, en los últimos meses, han trabajado en la búsqueda de fármacos para dotar de nuevas herramientas a los profesionales sanitarios para tratar el coronavirus. En el caso de PharmaMar, se ha centrado en plitidepsina, un fármaco de origen marino, comercializado por la compañía bajo el nombre de Aplidin® en Australia.
El virólogo español Adolfo García Sastre -director del Instituto de Patógenos Emergentes del Hospital Monte Sinaí de Nueva York- ha estado en contacto con PharmaMar y en este vídeo se le puede ver hablando de Aplidin.
Plitidepsina actúa bloqueando la proteína eEF1A, presente en las células humanas, y que es utilizada por el SARS-CoV-2 para reproducirse e infectar a otras células. Mediante este bloqueo, se evita la reproducción del virus dentro de la célula haciendo inviable y su propagación al resto. Las investigaciones del Centro Nacional de Biotecnología del CSIC demostraron que plitidepsina mata el coronavirus con una potencia sorprendentemente alta (0,5 nanomolar).
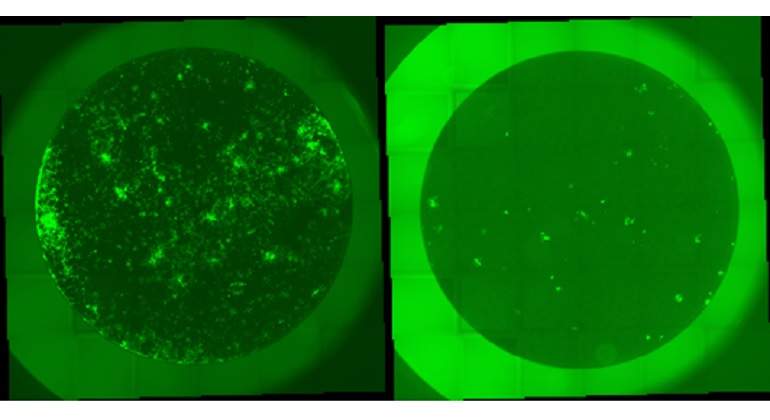
Además, plitidepsina está siendo investigada en importantes laboratorios de todo el mundo, como el Instituto Pasteur de Corea o el Hospital Monte Sinaí de Nueva York, en los que se ha demostrado que plitidepsina tiene una potencia más de 1.000 veces superior contra el SARS-CoV-2 que otros antivirales.
En abril, PharmaMar dio comienzo al ensayo clínico APLICOV-PC con plitidepsina para el tratamiento de pacientes con COVID-19, autorizado previamente por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Se trata de un estudio multicéntrico, aleatorizado, paralelo y abierto, que evalúa el perfil de seguridad y la eficacia de tres dosis de plitidepsina en pacientes con virus ingresados en hospitales. En el estudio están participando hasta diez centros: Hospital Clínico San Carlos, Hospital Ramón y Cajal, Hospital HM Montepríncipe, Hospital Universitario de La Princesa, Hospital Quironsalud de Madrid, Hospital Germans Trias i Pujol, Hospital Clínic i Provincial, Hospital de la Santa Creu i Sant Pau de Barcelona, Hospital General de Ciudad Real y Hospital de Guadalajara.
Es una muestra más del compromiso de PharmaMar con la investigación en materia, no solo oncológica, sino de salud en general. Y es que la innovación es uno de los pilares de esta empresa que se basa en el mar para buscar fármacos para combatir el cáncer. Sin duda, una gran fuente de inspiración.
